W czerwcu usłyszeliśmy, że Kymera wraz z Sanofi przerwała swój najbardziej zaawansowany i niezwykle obiecujący projekt. Projekt degradera klinicznego (badanego u pacjentów), usuwającego białko IRAK4 w leczeniu chorób autoimmunologicznych w tym chorób dermatologicznych.
Natychmiast pojawiły się głosy, że 1) IRAK4 to zły cel molekularny (bo wcześniejsze inhibitory kliniczne również nie zadziałały) i 2) technologia celowanej degradacji białek się nie sprawdza itp.
Mnie najbardziej zaskoczyła jednak reakcja rynku, bo negatywne informacje nie wpłynęły na kurs Kymery (może dlatego, że Kymera równolegle ogłosiła partnering z Gileadem). Jak zatem patrzeć na przerwanie projektu? Jest kilka płaszczyzn, na które zwracam uwagę:
- Biznesowa. Sanofi zdecydowało o kontynuacji projektu degraderów białka IRAK4 wspólnie z Kymerą, ale koncentrując się na innej cząsteczce niż kliniczny degrader KT-474. Moja interpretacja tej decyzji jest taka, że degradacja IRAK4 przekłada się na efekt terapeutyczny i że jest to projekt wart kilka miliardów dolarów rocznie (w sensie sprzedaży).
- Naukowa. Kymera dosyć powszechnie chwaliła się swoimi wynikami klinicznymi cząsteczki KT-474 i stąd wiemy, że pod wieloma względami jest to degrader wybitny. Usuwa praktycznie 100% białka IRAK4 komórkach krwi obwodowej (czyli tam, gdzie powinien) i przez długi czas (do 7 dni od podania!). Wiemy, że usunięcie białka IRAK4 było dobrze tolerowane przez pacjentów/zdrowych ochotników i że przekładało się to na redukcję cytokin prozapalnych. Czyli tak jak powinno.
Co zatem mogło pójść nie tak? W chorobach przewlekłych, które nie są śmiertelne, poprzeczka w zakresie bezpieczeństwa leków jest zawieszona bardzo wysoko. Jeśli miałbym zgadywać, to obstawiałbym, że w szerszej populacji zaobserwowano sygnał, który w autoimmunologii nie jest akceptowalny np. Zespół długiego QT (ang. QT-prolongation), czyli niekorzystny wpływ na układ sercowo-naczyniowy lub inny podobny odczyt. Jeśli nie zna się przyczyny takiej obserwacji, to tego typu problem może być istotny. Sanofi jednak zdecydowało się kontynuować projekt (na nowej cząsteczce będącej w rozwoju przedklinicznym), co sugeruje, że mógł to być efekt spodziewany. Myślę, że dla przerwanej cząsteczki KT-474 obserwowano wcześniej jakieś subtelne sygnały bezpieczeństwa w badaniach przedklinicznych. I jeśli znowu miałbym zgadywać, to byłby to strzał w test hamowania aktywności kanałów i transporterów, gdzie KT-474 mógł słabo wpływać na któreś z białek wrażliwych dla funkcjonowania ludzkiego organizmu. Hamowanie to mogłoby się jednak inaczej objawiać u pacjentów. Na pewno sygnał bezpieczeństwa musiał być słaby, bo jakby był umiarkowany lub średni, to ani Kymera by nie kontynuowała rozwoju tej cząsteczki, ani Sanofi nie podjęłoby ryzyka drogiego partneringu.
Mam też duże przekonanie, że IRAK4 jako cel molekularny, został dobrze zwalidowany. Również myślę, że Sanofi jest przekonane, że Kymera wyeliminowała już problem poprzez chemiczną optymalizację degradera oraz że samo usunięcie białka IRAK4 jest u pacjentów bezpieczne. Opóźnienie to jednak nie pozostaje bez znaczenia dla zespołu Kymera/Sanofi, ponieważ Nurix wespół z Gileadem bada swój degrader IRAK4 już w pierwszej fazie klinicznej. Kalifornijczycy są zatem 2-3 lata do przodu.
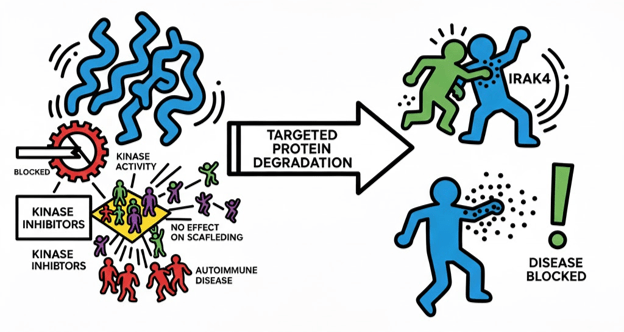
Jako bonus jeszcze kilka słów o tym, dlaczego inhibitory IRAK4, czyli leki hamujące, nie zadziałały w wielu badaniach klinicznych, prowadzonych przez największe firmy farmaceutyczne. IRAK4 jest białkiem należącym do rodziny kinaz białkowych, czyli białek przeprowadzających reakcję biochemiczną – tzw. fosforylację. Prace przemysłu farmaceutycznego były skoncentrowane na zahamowaniu właśnie tej aktywności enzymatycznej. Okazało się jednak, że IRAK4 ma również drugą funkcję, której inhibitory nie hamowały. Jest to tzw. funkcja rusztowania molekularnego (ang. scaffolding), czyli IRAK4 tworzy platformę umożliwiającą oddziaływanie wielu białek ze sobą. Funkcja ta prowadzi do rozwoju chorób autoimmunologicznych. Stąd IRAK4 wydawał się idealnym celem dla technologii celowanej degradacji białek, bo ta, usuwając białko, wyłącza w tym samym momencie wszystkie patologiczne aktywności białka.